新規申請手続案内
申請書類の提出
認定再生医療等委員会電子申請システムにて、申請書類をご提出いただきます。
事務局より、認定再生医療等委員会申請システムのURLを連絡します。
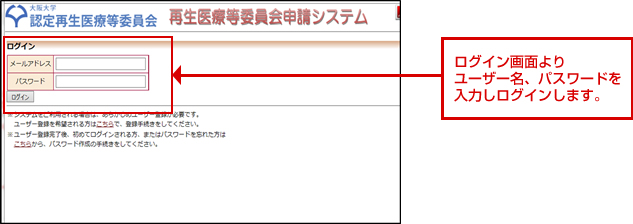
案内に沿ってユーザー登録をしてください。
ユーザー登録後、詳しい操作方法について事務局より連絡します。
申請書類
-
研究の場合、様式第1の案(jRCTにて作成し、一時保存されたものを推奨)
治療の場合、様式第1の2の案(e-再生医療にて作成し、一時保存されたものを推奨)
①細胞提供者又は代諾者に対する説明文書及び同意文書の様式 (再生医療等に用いる細胞の提供を受ける場合)
②再生医療等を受ける者及び代諾者に対する説明文書及び同意文書の様式
③再生医療等提供計画に記載された再生医療等の内容をできる限り平易な表現を用いて記載したもの - 提供する再生医療等の詳細を記した書類 (研究の場合は研究計画書)
※核酸等を用いる医療技術を用いる場合(in vivo/ex vivo遺伝子治療等)
提供する再生医療等の詳細を記した書類に記載及び添付が必要な事項チェックリスト - 実施責任者及び再生医療等を行う医師又は歯科医師の氏名、所属、役職及び略歴を記載した書類
- 再生医療等提供計画に記載された再生医療等と同種又は類似の再生医療等に関する国内外の実施状況を記載した書類
- 再生医療等提供計画に記載された再生医療等に用いる細胞/核酸等に関連する研究を記載した書類(特定細胞加工物等を用いる場合)
- 特定細胞加工物等概要書、特定細胞加工物等標準書、衛生管理基準書、製造管理基準書、品質管理基準書 (特定細胞加工物等を用いる場合)
※医療用に承認されていない器具、試薬を用いる場合は安全性を示す資料 (Certificate of Analysis、Certificate of Origin等)を添付 - 医薬品又は再生医療等製品の注意事項等情報(医薬品又は再生医療等製品を用いる場合)
- 委託契約書の写しその他これに準ずるもの(特定細胞加工物等の製造を委託する場合)
- モニタリングに関する手順書、必要に応じて監査に関する手順書(研究の場合)
- 様式A利益相反管理基準及び様式E利益相反管理計画(研究の場合)
- 必要に応じて統計解析計画書(研究の場合)
- 規則第97条第4項に該当する手順書(特定細胞加工物等を用いる場合)及び確認書
- 再生医療等提供基準等チェックリスト(申請者がセルフチェックをしたリスト)
- 再生医療等に関する記録及び保存の方法を記載したもの
- 疾病等の発生の場合の措置及び疾病等の報告の方法を記載したもの
- 再生医療等の提供の状況に関する定期報告等の方法を記載したもの
- 不適合の管理の方法を記載したもの
- 利用予定の臍帯血プライベートバンクが厚生労働省に届出を行った書類(臍帯血プライベートバンクを利用する場合)
- 被験者の募集手順(広告等)に関する資料(研究の場合)
- その他委員会が必要と認める資料
記載例はこちら









