研究紹介
日常の臨床研究支援業務の中で発生した統計学的な課題や疑問に対して、新たな方法論を研究しています。
現場のニーズに応えながら 未来の医療に貢献すべく、我々は日々挑戦し続けています。
科研費研究
1.「リアルワールドデータ品質評価指標の構築と臨床研究への応用」
(科学研究費基盤研究B(一般)課題番号:19H04496 代表:山田知美)
改正GPSP省令およびICH E6 (GCP) の大改定により、臨床試験や市販後調査への 診療録データ(RWD)利用が急速に拡大することが予想されます。RWDを研究に用いる場合には、研究者自らが“データが研究に耐えうる品質を伴っているか否か”を判断しなければなりませんが、「RWDを活用するために必要なデータ品質」に関する研究や議論は殆どなされていません。本研究では、データそのものの品質に目を向け、アカデミアのデータセンターが支援する臨床研究の既存データと、それに紐づく診療録データを比べることにより、RWDの品質を確認・評価すると共に、RWDの品質を判断するための評価指標・測定基準の構築を目指します。構築した基準の妥当性・再現性が確認できれば、研究者が臨床試験に応用することで、エビデンスの創出や研究効率の向上に繋がることが期待されます。
| IRB承認番号 | 19153 |
|---|---|
| 研究の対象 |
|
| 研究期間 | 2019年9月20日 ~ 2025年3月31日 |
| 研究に用いる情報 |
|
| 情報を利用する者の範囲 | 上記の研究組織内で利用しますす。 |
| 個人情報の取り扱い | プライバシー確保のため、患者さんが特定できないようにデータを処理した上で研究解析を行います。また、研究結果を公表する際には、患者さん個人が特定されることはありません。 ※ 個人情報管理は、以下の者が管理します。 大阪大学医学部附属病院:真鍋史朗(医療情報部)、山下公太郎(消化器外科)、吉波哲大(乳腺内分泌内科) 大阪府立病院機構大阪国際がんセンター:中山貴寛(乳腺内分泌外科) 東京医科歯科大学病院:山田知明(医療情報部) |
| 本研究への協力を拒否する場合 | 本研究に関するご質問等がありましたら下記連絡先までお問い合わせください。また、本研究への参加を承諾されない方は研究対象としませんので、下記の連絡先までお申し出ください。 |
| 問い合わせ先 | 〒565-0871 大阪府吹田市山田丘2-2 大阪大学医学部附属病院 未来医療開発部データセンター 山田 知美 Tel: 06-6210-8318 |
共同研究
1.「共通DWH出力データの製造販売後データベース調査への適合性検証」
1)背景
製造販売後(製販後)調査は、すでに国内で販売されている医薬品の副作用等について調べるもので、法律により実施が求められています。製販後データベース(DB)調査は、製販後調査にデータベースを用いるもので、より幅広く正確な情報が得られるといった利点が期待されていますが、まだ実施例は多くありません。 医療情報データウェアハウス(DWH)とは、電子カルテなどのさまざまな医療情報を、さまざまな目的で活用できるように集約する基盤です。共通データウェアハウス(DWH)は、大阪大学が連携病院とともに運用している、医療情報DWHです。 DPCデータとは、日本国内の多くの病院等で、診療報酬の支払い手続きに使用されている標準形式にのっとったデータです。その病院に入院された患者さんの基本情報(年齢や性別)、主な診断名、主な手術や処置、投与された薬剤の種類と量、入院日数、退院時の状況(死亡)等が収録されています。 リアルワールドデータ(RWD)社は、医療関連データを扱う国内の企業です。DPCデータ等の扱いや、こうした領域の法律等についての経験があります。また、多くの医療機関を対象とする営業ネットワークを持っています。同社の事業の一つに、DPCデータ等を利用して行う製販後DB調査サービスがあります(図1)。
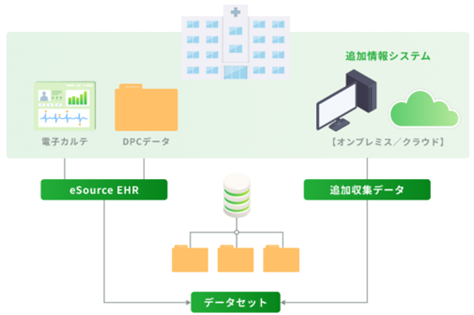
引用元:https://rwdata.co.jp/pharmaceutical/
図1.製版後DB調査サービスの概要
2)研究目的・方法
本研究の目的は、共通DWHに格納されているデータを、RWD社が実施予定の製販後DB調査に使用する上で問題がないかを検証し、問題があった場合にはこれに対処することです。(図2) 共通DWHの出力データを加工してDPCデータを作成します。これをRWD社のアプリケーション(EHR Capture)により変換し、同社が製販後DB調査に使用するシステム用のデータ①を生成します。あわせて、通常の診療報酬手続きに使用されているDPCデータを、同じくEHR Captureにより変換して、データ②を生成します。データ①とデータ②を比較して、もし差違があった場合には、共通DWHまたはこれに関連するプログラムを修正した上でデータ①を再作成し、これをデータ②と比較します。これを繰り返し、共通DWHから得るDPCデータがRWD社の製販後DB調査用システムに問題なく利用可能であるかどうかを検証します。
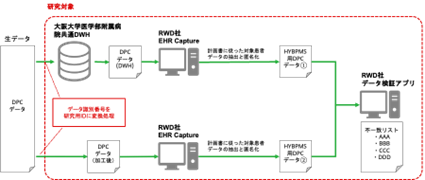
図2.データ検証フロー
3)研究に用いる試料・情報の種類
共通DWHに含まれるデータ、および、診療報酬請求目的で使用されているDPCデータを使用します。これらには入院患者の基本的な情報(年齢や性別)、主な診断名、主な手術や処置、投与された薬剤の種類と量、入院日数、退院時の状況(死亡)等が含まれます。いずれも、事前に仮名化した上で用います。つまり、誰についての情報化は判別できないように加工してから用います。 データ以外の試料は扱いません。
4)外部への試料・情報の提供
本研究の手順のうち、RWD社のアプリケーションを使用する部分は、本研究の分担研究者であるRWD社の社員が行います。これらは全て、当院医療情報部の部屋で、同じく医療情報部の職員の立ち会いの下で行います。データが当院外に持ち出されたり、他の個人や組織に提供されることはありません。
| 研究の対象 | 2022年4月1日~2025年3月31日に大阪大学医学部附属病院(当院)に入院した患者 |
|---|---|
| 研究組織 | 研究代表機関:大阪大学 医学部附属病院 未来医療開発部 データセンター センター長・特任教授 山田 知美 共同研究機関:リアルワールドデータ株式会社 取締役 服部 雅優 |
| お問い合わせ | 本研究に関するご質問等がありましたら下記の連絡先までお問い合わせ下さい。
ご希望があれば、他の研究対象者の個人情報および知的財産の保護に支障がない範囲内で、研究計画書および関連資料を閲覧することができますのでお申出下さい。
また、情報が当該研究に用いられることについて患者さんもしくは患者さんの代理人の方にご了承いただけない場合には研究対象としませんので、下記の連絡先までお申出ください。その場合でも患者さんに不利益が生じることはありません。 |
| 連絡先 | 照会先および研究への利用を拒否する場合の連絡先: 大阪大学医学部附属病院 未来医療開発部 データセンター 一原 直昭 (いちはら なおあき) 〒565-0871 大阪府吹田市山田丘2-2 最先端医療イノベーションセンター棟 4階 TEL: 06-6210-8318 内線8318 |
2.「CDISC*基準に適合した治験実施計画書策定支援ツールの研究」
医薬品の製造販売承認申請を行う際には、評価資料となる臨床試験に関する電子データをCDISC標準に基づき作成し、規制当局に提出する必要があります。しかし、現状ではCDISC標準によるデータ取得を念頭におかずに治験実施計画書が作成されており、その結果様々な問題が生じています。私たちは、このような問題を未然に防止する支援ツールを開発するために、POCクリニカルリサーチ株式会社と平成30年から共同研究を実施しています。
* CDISC : Clinical Data Interchange Standard Consortium
| 共同研究相手 | POCクリニカルリサーチ株式会社 |
|---|---|
| 研究期間(予定) | 平成30年10月1日~令和2年3月31日 |
3.「製造販売後調査等における大阪臨床研究ネットワーク(OCR-net) 活用のための評価共同研究」
GPSP省令の改正により、従来の使用成績調査や製造販売後臨床試験に加えて、新たに医療情報データベースを用いた製造販売後データベース調査が、医薬品の再審査等の申請のため実施できるようになりました。私たちは、この製造販売後データベース調査の実施において、大阪大学医学部附属病院医療情報部が開発し、電子カルテからデータ転送を行うことができるCDCS*が有用であるかを検証するために、大阪国際がんセンター及び日本イーライリリー株式会社と平成31年から共同研究を実施しています。
*CDCS : Clinical Study Data Collecting System
| 共同研究相手 | 大阪国際がんセンター 大阪大学医学部附属病院医療情報部 日本イーライリリー株式会社 |
|---|---|
| 研究期間(予定) | 平成31年6月1日~令和元年12月31日 |
4. 診療科と取り組む Quality Management ~支援範囲の拡大を目指して~
大阪大学では、毎年約500件の臨床研究が倫理委員会に申請され、年間2,000を超える臨床研究が実施されていますが、未来医療開発部でデータセンター業務を受託している案件は約40件です。これまで委受託による業務支援については、未承認の医薬品・医療機器等の開発研究(医師主導治験や再生医療製品等)を優先してきましたが、EBM創出のための臨床研究の数は多く、広く研究者らを支援する体制の構築はAROデータセンターの使命と考えています。 当データセンターは、治験から観察研究まで幅広く研究者を支援することを目標に、実務的支援だけでなく、教育的支援、さらには、各診療科との共同研究という形で、限られたリソースで臨床研究の質を科学的に担保するための方法論の開発を行っています。 医師、生物統計家、データマネージャー等が、それぞれの専門性を生かし、相互理解を深めながら、協同で臨床研究の品質管理システム(Quality Management System; QMS)の構築を目指します。
1)「医師と行うQMS体制構築 ~CDCSと連携したデータマネージメント補助ツールの開発~」
臨床研究の質が適切に担保されるようなQMS体制を医師と協同で構築すると共に、“進捗管理表作成ツール”や“入力促進メール作成ツール”等を開発し、研究者に提供することで業務負担の軽減を図ります。これらの補助ツールは、大阪大学医療情報部が開発したEDCシステム(CDCS)と連携したツールとして、広く研究者に提供できるようExcelで利用可能なVisual Basic for Applications (VBA)で作成しました。より汎用的なツールに改良を重ねていく予定です。
| 共同研究相手 | 大阪大学医学部附属病院 循環器内科(OCVC) |
|---|---|
| 対象となる研究 |
「左室収縮能が保たれた心不全の予後に関する多施設共同前向き観察研究」 ・目標症例数:1500例 ・参加施設数:31施設 ・使用するEDCシステム:CDCS(Clinical study Data Collecting System) ・実施体制:診療科内で医師が調整事務局とデータマネージメントを実施 |
| 研究期間(予定) | 平成28年2月24日~令和10年3月31日 |
2)「診療科に在籍する品質管理担当者の育成とQMS体制構築」
診療科に品質管理担当者を配置いただき、医師主導型多施設共同臨床試験のデータマネージメント及び中央モニタリング業務を担う人材を育成します。診療科内で臨床研究実施体制を整備することで、臨床研究の質の向上に加え、AROデータセンターにおけるリソース不足の解消と支援範囲の拡大を目指します。
| 共同研究相手 | 大阪大学医学部附属病院 消化器内科 |
|---|---|
| 対象となる研究 |
「C型肝炎ウイルス排除治療による肝硬変患者のアウトカムに関する多施設共同観察研究」
・目標症例数:1500例 ・参加施設数:全国25施設 ・使用するEDCシステム:REDCap ・実施体制:診療科内で医師が調整事務局、診療科在籍の品質管理担当者が中央モニタリングとデータマネージメントを実施 |
| 研究期間(予定) | 平成31年3月5日~令和6年3月31日 |
3)「アカデミアのための中央モニタリング手法の開発 ~施設モニターの教育~」
アカデミアで行う多施設共同臨床研究には、研究実施に不慣れな施設が含まれることもあります。また、資金面やリソース不足により、CRCや専属モニターの配置が困難な場合も少なくありません。そこで、CRCや専属モニターを配属できないような体制においても、一定の品質を保つことが可能となる効率的な中央モニタリング手法の開発を目指して、共同研究を実施しています。
| 共同研究相手 | 大阪大学医学部附属病院 行動神経学・神経精神医学寄附講座 |
|---|---|
| 対象となる研究 |
「特発性正常圧水頭症における症状改善のための臨床研究 ?アルツハイマー病理が疑われる患者に対するシャントの有効性・安全性に関して?」 ・研究デザイン:RCT ・目標症例数:150例 ・参加施設数:全国33施設 ・使用するEDCシステム:DATATRAK ONE ・実施体制:診療科内で医師が調整事務局、当センターが中央モニタリングとデータマネージメントを受託、オンサイトモニタリングは各施設に配置した施設モニターが実施 |
| 研究期間(予定) | 令和元年5月27日~令和5年1月31日 |
