被験者保護プログラム計画
1 目的
大阪大学医学部附属病院(以下、当院)は、臨床研究の研究対象者の人権の保護、安全の保持及び福祉の向上に責任を持って取り組む。本計画の目的は、倫理的な臨床研究を促進し、適用される法律、規制及び方針の遵守を促進するために、当院の被験者保護プログラム(Human Research Protection Program Plan 以下、HRPP)の枠組みを確立することである。
当院のHRPPは、臨床研究の研究対象者の人権の保護、安全の保持及び福祉の向上を確保するための包括的なシステムである。HRPPは、当院のすべての職員及び委員会が、本計画に記載されたそれぞれの役割と責任を果たすことに基づいている。
2 使命
当院のHRPPの使命は、当院が監督する臨床研究の研究対象者の人権の保護、安全の保持及び福祉の向上を確保することである。
3 用語の定義
3.1 HRPPの対象者
HRPPの対象となる者とは、大阪大学大学院医学系研究科及び医学部並びに大阪大学医学部附属病院に所属する、臨床研究の実施に携わる全ての教職員又は学生をいう。
3.2 人を対象とする医学系研究 / 臨床研究
人を対象として、次の(1)又は(2)を目的として実施される活動をいう。
(1)傷病の成因(健康に関する様々な事象の頻度及び分布並びにそれらに影響を与える要因を含む。)の理解、病態の理解、傷病の予防方法の改善又は有効性の検証、医療における診断方法及び治療方法の改善又は有効性の検証を通じて、国民の健康の保持増進又は患者の傷病からの回復若しくは生活の質の向上に資する知識を得ること
(2)人由来の試料・情報を用いて、ヒトゲノム及び遺伝子の構造又は機能並びに遺伝子の変異又は発現に関する知識を得ること
3.3 臨床試験
臨床研究のうち、介入を伴う研究をいう。
介入
研究目的で、人の健康に関する様々な事象に影響を与える要因(健康の保持増進につながる行動及び医療における傷病の予防、診断又は治療のための投薬、検査等を含む。)の有無又は程度を制御する行為(通常の診療を超える医療行為であって、研究目的で実施するものを含む。)をいう。
3.4 治験
臨床試験のうち、医薬品、医療機器、再生医療等製品の製造販売承認申請の際に提出すべき臨床試験の試験成績に関する資料の収集を目的とする臨床試験をいう。
3.5 研究対象者
次に掲げるいずれかに該当する者(死者を含む。)をいう。
(1)臨床研究を実施される者(臨床研究を実施されることを求められた者を含む。)
(2)臨床研究に用いられることとなる既存試料・情報を取得された者
3.6 研究者
臨床研究を実施する者をいう。一般的に、臨床研究を実施するとは以下を行うことをいう。
(1)研究対象者に対し介入あるいは観察することでデータを得る
(2)研究対象者に関する特定の個人を識別することができる個人情報又は試料を得る
(3)研究対象者からインフォームドコンセントを受ける
ただし、研究機関以外において新規試料・情報を取得し、研究機関に提供のみを行う者、既存試料・情報の提供のみを行う者、及び委託を受けて研究に関する業務の一部に従事する者を除く。
3.7 研究スタッフ
研究者以外の臨床研究に携わる関係者をいう。研究者の指導の下に臨床研究に係る業務に協力する者(臨床研究コーディネーター等)、臨床研究の技術的補佐や事務に従事する職員を含む。
3.8 研究責任者/治験責任医師/研究責任医師
一つの機関において、臨床研究を実施するともに、当該臨床研究に係る業務を統括する者をいう。規制により「治験責任医師」、「研究責任医師」、「実施責任者」と定義される。
4 倫理原則
臨床研究を実施する際は、ヘルシンキ宣言に基づく倫理的原則を尊重し行うものとする。
5 規制要件
当院は、資金提供の有無に関わらず、すべての臨床研究に規程及び標準業務手順書に記載されている倫理基準を適用することを確約する。当院の研究者及び研究スタッフは、実施しようとする臨床研究に適応する以下の規制のいずれかあるいは複数を遵守しなければならない。なお、異なる法令あるいは規制に抵触する場合、より厳格な規定を優先して適用する。
- 医薬品の臨床試験の実施の基準に関する省令(平成9年厚生省令第28号)
- 医療機器の臨床試験の実施の基準に関する省令(平成17年厚生労働省令第36号)
- 再生医療等製品の臨床試験の実施の基準に関する省令(平成26年厚生労働省令第89号)
- 臨床研究法(平成29年法律第16号)
- 人を対象とする生命科学・医学系研究に関する倫理指針(令和3年文部科学省・厚生労働省・経済産業省告示第1号)
- 再生医療等の安全性の確保等に関する法律(平成25年法律第85号)
臨床研究を実施する際は、規制に応じたIRBによる審査が必要である。
6 その他の要件
組織はスポンサーからの要望に応じて、ICH-GCP(E6)を適用するものとする。
臨床研究がEU一般データ保護規則(General Data Protection Regulation; GDPR)の対象となる場合、GDPRを適用するものとする。
7 HRPPの対象となる研究(Scope of Human Research Protection Program)
規制要件で示した法令、指針等に従って実施するすべての臨床研究を対象とする。
8 HRPPに関する規程・手順書
臨床研究を実施する際に必要な規程・手順書は以下のWEBサイトから入手できる。
http://www.dmi.med.osaka-u.ac.jp/acr/sop.html
規程及び重要な手順書が制定あるいは改訂される際は、病院運営会議に諮られ、診療科を含むすべての関連部署へ周知される。また、必要に応じて、電子メールにて通知される。
9 HRPPの構成要素
以下の臨床研究に携わる者は、その業務上知り得た情報を正当な理由なく漏らしてはならない。その業務に従事しなくなった後も同様とする。
9.1 病院長
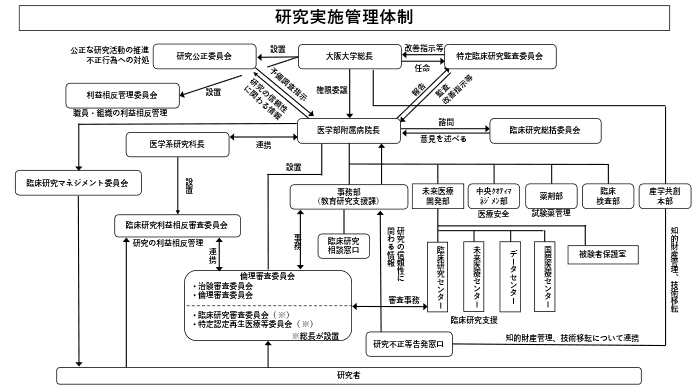
当院の管理運営を統括しており、当院のみならず総長及び大阪大学大学院医学系研究科長かつ医学部長から委任を受けて、大阪大学大学院医学系研究科及び医学部並びに大阪大学医学部附属病院に所属する研究者が実施する臨床研究を適正に実施するために必要な体制等を整備し、監督する責任を有するHRPPの責任者である。病院長には以下の権限及び責務がある。
- 実施を許可した臨床研究が適正に実施されるよう、必要な監督を行うことについての責任を負う。
- 臨床研究を適正に実施するためにリソースの配分及び必要な体制を整備する。
- IRBの意見を尊重し、臨床研究の実施の許可又は不許可その他必要な措置について決定する。なお、IRBが臨床研究の実施について不適当である旨の意見を述べたときには、当該臨床研究の実施を許可することはできない。
- 緊急に臨床研究を中断又は中止する必要があるときは、臨床研究の中断又は中止を指示する。
- 規制要件に基づき必要に応じて当該規制当局へ報告を行う。
- 本HRPP計画を含む、臨床研究に係る規程・手順書等を制定する。
- IRB委員を指名する。
- IRBの承認が得られ、病院長が実施の許可をする前に、臨床研究が開始されないことを確保する。
- コンプライアンスを監視し、特定された問題のコンプライアンスを改善するために教育的監査等の監査プログラムを実施する。
9.2 臨床研究総括委員会
病院長、臨床研究に係る部署の長等によって構成され、臨床研究を組織横断的に管理・監督する。隔月開催し、IRBの審査実績、臨床研究相談窓口で受け付けた苦情や相談の実績、研究不正・規制違反事案、教育的監査結果等を確認し、臨床研究の適正な実施を図るために必要に応じて改善指示を行う。臨床研究総括委員会には、以下の責務がある。
- 臨床研究の審査の独立性を確保し、強制や不当威圧の影響を受けないよう対応を検討する。
- IRB委員の評価を年1回実施する。
- HRPPの評価を年1回実施する。
- 施設
- 人員
- 教育研修の実施状況
- 利益相反管理に関する審査体制
- 品質改善計画
- アウトリーチ活動
- IRBの審査体制
- スポンサーあるいは研究者から被験者候補を提示した個人に支払われる費用(斡旋料)、登録率又は登録時期に連動して募集を促進するために行われる支払い(ボーナス払い)の妥当性を検討する。
9.3 IRB
当院において、臨床研究を審査するIRBは以下のとおりである。IRBはそれぞれの規制に基づき設置されており、医学又は医療等の専門家、法律又は生命倫理の専門家、一般の立場の者を有し、科学的及び倫理的観点から審査を行うことができる。IRBは、申請された臨床研究の学術的及び/又は科学的審査に責任を持ち、以下の事項を確認する。
- 臨床研究が適切な研究デザインに基づいていること
- 臨床研究の研究デザインが期待される知識を得るのに十分なものであること
また、審査が適正かつ公正に行えるよう、活動の自由及び独立が保障されている。
| 名 称 | 規 制 | 審査対象 | 設置者 | 運 営 |
|---|---|---|---|---|
| 大阪大学医学部附属病院 治験審査委員会 |
医薬品GCP/医療機器GCP/ 再生医療等製品GCP |
治験、製造販売後臨床試験 | 病院長 | 病院 |
| 大阪大学 臨床研究審査委員会 |
臨床研究法 | 医薬品等を人に対して用いることにより、当該医薬品等の有効性または安全性を明らかにする研究(治験、再生医療を除く) | 総長 | 病院 |
| 大阪大学医学部附属病院 介入研究等倫理審査委員会 |
人を対象とする生命科学・医学系研究に関する倫理指針 | 臨床研究法に該当しない介入研究侵襲(軽微な侵襲除く)のある研究 | 病院長 | 病院 |
| 大阪大学医学部付属病院 観察研究等倫理審査委員会 |
原則、介入・侵襲(軽微な侵襲除く)のない研究 | 病院長 | 病院 | |
| 大阪大学 第一特定認定再生医療等委員会 |
再生医療等の安全性の確保等に関する法律 | 第1種、第2種再生医療等に係わる提供計画(遺伝子治療以外) | 総長 | 病院 |
| 大阪大学 第二特定認定再生医療等委員会 |
第1種、第2種再生医療等に係わる提供計画(遺伝子治療のみ) | 総長 | 病院 |
IRBには被験者保護を保証するために以下の権限がある。
- 臨床研究の実施について、承認、修正の上承認、却下、保留の決定を行う。
- 実施中の臨床研究について、予期しない重大な副作用の発現等、臨床研究を継続することが適当でないと判断した場合は、当該臨床研究を中止又は中断する決定を行う。
- 臨床研究の同意過程や実施を監視するあるいは第三者に監視を依頼することができる。
- 臨床研究の計画、並びに被験者からインフォームドコンセントを得るのに使用される方法及び資料を審査し、また各規制に従い計画の変更、定期的な報告、安全性情報等に関する報告、逸脱・不適合に関する報告等に対して、継続的に審査を行うことで臨床研究の実施を監視する。
- 臨床研究に該当するか否かの最終的な判断を行い、当該IRBの審査対象に該当するか確認する。
- 大学院医学系研究科・医学部臨床研究利益相反委員会と連携し、研究者の利益相反の確認及び利益相反管理の妥当性を検討し、当該臨床研究の実施の可否の判断を行う。
外部のIRBに審査を依頼する場合は、以下の条件を満たしていることが必要である。
- 治験の場合、「大阪大学医学部附属病院 治験に係わる標準業務手順書」に規定する「外部治験審査委員会の選定」等に従う。
- 治験以外の場合は、原則一括審査であり、当院が研究代表者であって、特段の理由があり外部の委員会に委託する場合に限り、事前に病院長の許可を得る。
IRB委員長、委員及びIRB事務局員は、適用されるHRPPに関する規程・手順書等を遵守する責務がある。
9.4 未来医療開発部
4つのセンターと6つの室が連携して、「高度な医療技術の研究・開発」を統合的・効率的に支援する部である。臨床研究の支援に必要なスタッフの雇用を含む予算の管理、アウトリーチ活動や臨床研究に関わる苦情・相談の受付、事務部教育研究支援課と連携し地域病院における人材育成、教育研修、実施環境整備等を実施する。HRPPに関わる主な部署を以下に記載する。
臨床研究センター
実施体制の整備、教育、事務部教育研究支援課に協力しIRBの事務局業務の支援を行う。また、CRC(臨床研究コーディネーター)による臨床研究支援、モニターによるモニタリング受託等を行う。
未来医療センター
シーズ開発及びトランスレーショナルリサーチの推進、臨床研究におけるプロジェクトマネジメント、非臨床研究を含む計画及び実施支援、薬事、規制当局への対応の支援等を行う。
データセンター
臨床研究のデータマネジメント、統計解析を総合的に支援する。
国際医療センター
国際共同臨床研究を実施するための体制整備及び管理の支援等を行う。
被験者保護室
HRPPを実施、継続するために、HRPPに関する手順書、HRPPを評価し改善する計画、教育プログラムの策定を行う。不遵守の事案を収集し、HRPP遵守の監督を行う。被験者保護室には、以下の責務がある。
- 臨床研究の審査と実施に関連する苦情や申し立てを受け、対応を検討する。
- 定期的にHRPP計画を評価し、必要に応じて修正を検討する。
- 教育プログラムを策定し、実施する。
監査室
臨床開発やその支援を行う部署とは独立、分離された部門であり、臨床研究の監査及び教育的監査を実施し、結果を病院長に報告する。また、不適切事案の申し立て等があった場合、必要に応じて病院長の指示によりFor Couse Auditを実施する。
リサーチ・インテグリティ室
研究支援、審査に関連する職種の者で構成され、臨床研究に関する部署横断的な課題やリサーチ・インテグリティに関する問題の解決に取り組む。
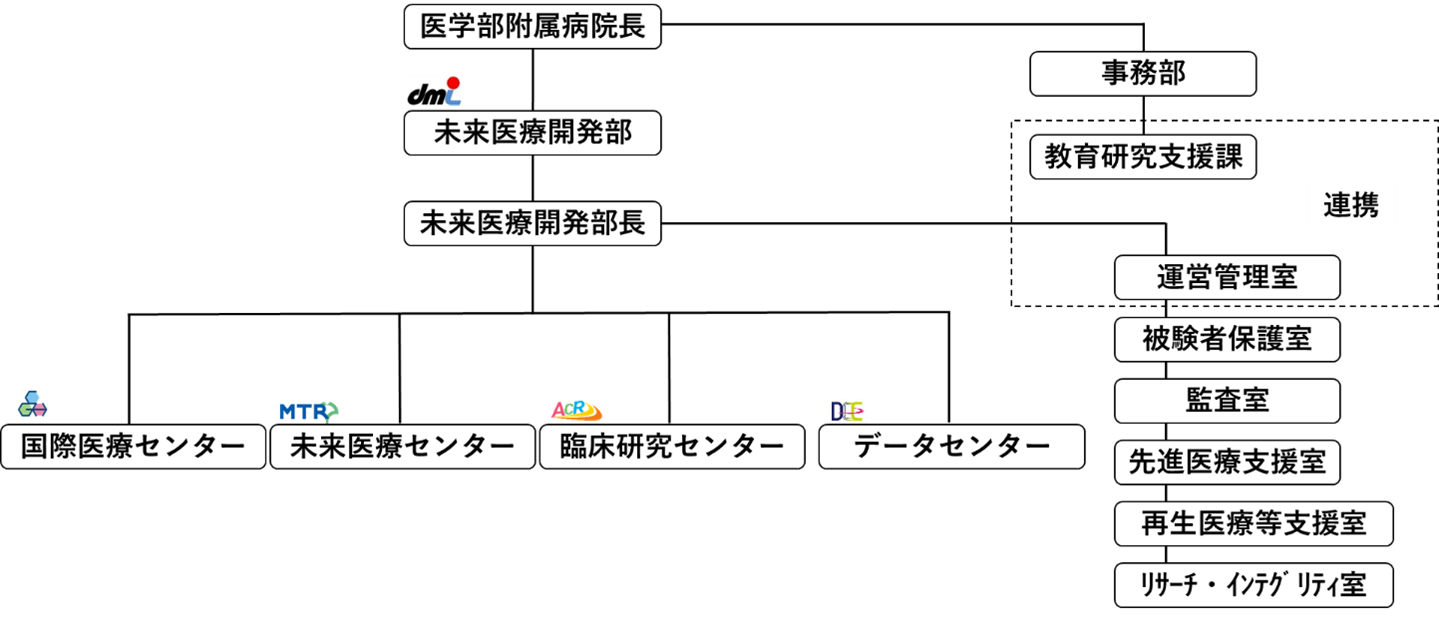
9.5 事務部教育研究支援課
IRBの事務局業務を行う。また、受託研究契約、共同研究契約の受け入れ治験契約、審査委受託契約を行う。その他、臨床研究総括委員会、臨床研究マネジメント委員会の事務、当院における研究不正等指針違反告発窓口、補償に関する手続き、臨床研究の概要や取組を紹介する市民フォーラムの企画を行う。
9.6 薬剤部
必要に応じて、臨床研究に用いる医薬品の受領、管理、調剤、返却などの業務とこれに付随する書類の保管を行う。
9.7 その他関連する委員会
臨床研究マネジメント委員会
当院に設置され、各診療科、中央診療施設から選出された臨床研究マネージャ―によって構成され、臨床研究に関わる業務を円滑に遂行するため、改善すべき問題や要望を収集し、情報共有する。不定期に開催される。
大阪大学特定臨床研究監査委員会
大阪大学に設置され、当院の臨床研究に関わる管理体制の取組状況を中立的かつ客観的な立場から監査する。年1回開催され、監査結果は病院長と総長に報告される。
大阪大学研究公正委員会
大阪大学に設置され、公正な研究活動の推進に関わる啓発活動、公正な研究活動の推進に関わる情報収集及び周知、研究者及び研究スタッフの不正行為に関する申立ての受付、調査及び認定等を行う。
大阪大学利益相反委員会
大阪大学に設置され、役員を含む職員及び組織の利益相反の管理を行う。
大学院医学系研究科・医学部臨床研究利益相反委員会
医学部に設置され、臨床研究毎の利益相反の確認及び利益相反管理の妥当性を検討する。ただし、利益相反管理を含めた臨床研究の実施の判断はIRBにて行われる。
9.8 研究者及び研究スタッフ
研究者及び研究スタッフには以下の責務がある。
- 臨床研究の実施に関する規程・手順書に従うこと。
- IRB及び病院長による決定と追加要件に従うこと。
上記に加え、研究責任者には以下の責務がある。
- 臨床研究を適正かつ安全に実施するための、研究者の十分な時間、適切な資格、設備、スペース等のリソースがあることを確認する。
- 研究者及び研究スタッフが、臨床試験を実施するための資格(教育研修、専門知識、資格、権限等)を有していることを確認する。
研究者は、以下の研究対象者の保護に関連する情報はすべて、直接あるいは病院長を通じて、速やかにIRBに報告しなければならない。外部のIRBに審査を依頼する場合も同様である。ただし、外部のIRBが、より早急な報告を求める場合等は、当該IRBの手順に従うこととする。
- 研究参加者に生じた重篤な有害事象/報告が必要な疾病等又は不具合
- 研究に関連する安全性情報
- 治験においては緊急の危険を回避するための逸脱(治験のみ)
- 重大な逸脱/重大な不適合
10 教育的監査及びFor Cause Audit
一定数の個々の臨床研究について、該当する規制、実施計画書、IRBの審査や教育訓練の受講等の必要な手続き等のコンプライアンスを向上するために、病院長が監査担当者を指名し、教育的監査を行わせる。また、被験者の権利、安全及び福祉を脅かす事案、偽造又は捏造、懸念、苦情等があり、臨床研究の信頼性について確認が必要となった場合、その原因究明のために、病院長が監査担当者を指名し、For Cause Auditを行わせる。病院長は、教育的監査及びFor Cause Auditの結果を確認し、改善すべきノンコンプライアンスが発見された場合は、必要な対応を行う(例えば、教育訓練の未受講があれば対象者に早急に受講させる等)。また、必要に応じて研究者に是正措置及び予防措置の策定を指示し実施させる。
11 品質改善プログラム
適応される規制や手順に対するコンプライアンスを達成、維持し、HRPPの品質、効率性、有効性の目標レベルを達成するために品質改善プログラムを実施している。被験者保護室は、1年毎に、QC活動、教育的監査及びFor Cause Audit、その他の調査等の結果を収集、評価し、品質改善すべき問題点を抽出し、目標(Object)を検討する。その後、関連部署と協力し、目標を達成するための対策及び評価方法を検討の上、品質改善計画を作成し、臨床研究総括委員会に報告する。その後、対策を実施し、評価を行い、結果を臨床研究総括委員会に報告する。
12 教育研修
研究者、研究スタッフ、IRB委員長や委員、IRB事務局員は、業務開始までに導入教育研修の受講修了が必要である。また、次年度以降は継続教育研修の受講修了を求めている。 研究責任者は、研究者及び研究スタッフが教育研修の要件を満たしているか確認し、要件を満たしていない者については、要件を満たすまで当該臨床研究の実施に関与させてはならない。 IRB事務局は、IRB委員長や委員、IRB事務局員の教育研修の要件を満たしているか確認し、要件を満たしていない場合、必要に応じて教育研修を受講させる。 詳細は、「大阪大学医学部附属病院における臨床研究等に係わる教育研修に関する標準業務手順書」を参照のこと。
13 地域病院との連携/他施設支援
適正かつ効率的に多施設共同臨床研究を実施するために、他施設に対し、臨床研究の実施に関する相談に応じ、必要な情報の提供、助言その他の援助、臨床研究に関する人材育成、教育研修、実施環境整備等を行う。
14 研究者等からの質問、意見、提案への対応
研究者及び研究スタッフは臨床研究マネジメント委員会、臨床研究総括委員会、未来医療開発部意見交換会にて、臨床研究に関する疑問や、改善してほしいことを直接表明することができる。それらの意見は、臨床研究総括委員会を通じて病院長へ報告され、対応が検討される。
加えて、質問、意見、提案、HRPPに関する追加情報の要望、臨床研究の支援などについては、以下のサイトにて問合せ先を参照することができる。
http://www.dmi.med.osaka-u.ac.jp/dmi/fix.html
15 患者、被験者等からの苦情、相談への対応
臨床研究相談窓口としてブース及びWEBサイトを設置し、臨床研究に携わる医療従事者が対面、電話、電子メールにて患者、被験者、あるいはその家族等からの臨床研究に関する苦情や相談に迅速に対応している。担当スタッフは、苦情や相談に対応した記録を作成し、直近の臨床研究総括委員会に報告する。臨床研究総括委員会は必要に応じて研究者、IRB、関連部署等へ対応を指示する。 また、臨床研究の同意説明文書には、研究者の連絡先に加え、臨床研究相談窓口を記載することとしている。さらに規制に応じて以下の連絡先を記載し、被験者等からの苦情や相談に対応している。
- 治験においては、臨床研究コーディネーターの連絡先
- 臨床研究法及び再生医療等の安全性の確保等に関する法律にて規制される臨床研究は、IRBの窓口
16 アウトリーチ活動
教育研究支援課と未来医療開発部が主体となって、アウトリーチ活動として、臨床研究に関する市民フォーラムの開催、院内における治験に関するポスター掲示やパンフレットの設置、治験キャンペーン等を企画し実施している。また、当院のWEBサイトに、一般の方向けの臨床研究の説明、臨床研究の実施方針、実施中の臨床試験を公表している。これらのアウトリーチ活動は、臨床研究総括委員会により年1回自己点検評価票を用いて評価され、定期的に見直される。その結果は、大阪大学特定臨床研究監査委員会により中立的かつ客観的立場から監査される。また、IRBのWEBサイトにて、IRBに関する規程、委員名簿、議事録の概要を公表している。また、介入を行う臨床研究は、研究者により厚生労働省が整備するデータベース(https://jrct.mhlw.go.jp/)等の公開データベースに公表されている。
17 コミュニティ参加型研究の実施
研究者はコミュニティに基づく参加型研究を実施する際は、AMEDの患者・市民参画(PPI)ガイドブックを参照し、必要に応じて、研究のデザイン、実施、結果の還元に、地域の住民、患者支援団体等の関与を検討するものとする。
https://www.amed.go.jp/ppi/
IRBはコミュニティに基づく参加型研究を審査する際は、必要に応じて以下を考慮し、積極的に関与するものとする。
- コミュニティに基づく参加型研究に関する教育をIRB委員に提供する
- コミュニティに基づく参加型研究の有識者に意見を聴く
- IRBへの申請書類に、コミュニティの関与に関する情報を記載させる
18 HRPP計画の制定と改訂
本HRPP計画は被験者保護室にて作成し、病院長の承認を得て制定する。改訂の場合も同様とする。制定・改訂されたHRPP計画は以下のウェブサイトにて公開する。
http://www.dmi.med.osaka-u.ac.jp/acr/sop.html
19 AAHRPPへの報告
以下を知り得た場合、速やか(遅くとも48時間以内)にAAHRPPに報告する。
- 規制当局による否定的な措置
- 臨床研究に関連した訴訟、仲裁、和解の開始
- 被験者保護プログラムに関連した否定的な報道
制定・改訂履歴
| 文書番号 | 版番号 | 制定・改訂日 | 改訂理由 |
|---|---|---|---|
| P-01 | 1.0 | 2022年03月01日 | - |
| P-01 | 2.0 | 2024年10月01日 | 定期的な見直しのため |
| P-01 | 2.1 | 2025年04月01日 | 17 コミュニティ参加型研究の追加 その他、記載整備 |

